Diapositiva 1 - PowerPoint PPT Presentation
1 / 34
Title: Diapositiva 1
1
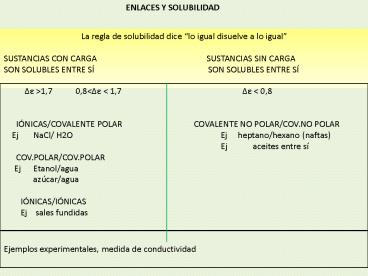
ENLACES Y SOLUBILIDAD
La regla de solubilidad dice lo igual disuelve a
lo igual SUSTANCIAS CON CARGA
SUSTANCIAS SIN
CARGA SON SOLUBLES ENTRE SÍ
SON SOLUBLES
ENTRE SÍ
?e gt1,7 0,8lt?e lt 1,7 IÓNICAS/COVALENTE POLAR COVALENTE NO POLAR/COV.NO POLAR Ej NaCl/ H2O Ej heptano/hexano (naftas) Ej aceites entre sí COV.POLAR/COV.POLAR Ej Etanol/agua azúcar/agua IÓNICAS/IÓNICAS Ej sales fundidas
Ejemplos experimentales, medida de conductividad
?e lt 0,8
2
PARA DETERMINAR EXPERIMENTALMENTE EL TIPO DE
ENLACE, TENGA EN CUENTA LAS SIGUIENTES
CONSIDERACIONES Dada una sustancia ES SOLUBLE
EN AGUA?
ES IÓNICA
SI
LA SOLUCIÓN CONDUCE LA ELECTRICIDAD?
SI
ES COVALENTE POLAR
NO
NO
ES COVALENTE NO POLAR
Y LUEGO COMPARE EL TIPO DE ENLACE DETERMINADO
EXPERIMENTALMENTE CON EL TIPO DE ENLACE QUE
PREDICE EL CÁLCULO. OBSERVE QUE EN EL CASO DE
SUSTANCIAS CUYOS ?e SON CERCANOS A VALORES QUE
SEPARAN UN TIPO DE ENLACE DE OTRO, ES
DETERMINANTE LA MEDIDA EXPERIMENTAL.
3
PILAS
- La Oxidación se produce en el polo - (ánodo)
será el electrodo que tiene menor potencial de
reducción. - La Reducción se produce en el polo (cátodo)
será el electrodo que tiene mayor potencial de
reducción - Cu2 (ac)/Cu (s) 0,34 v.
- Zn2 (ac)/Zn (s) -0,76 v.
- Polo Cu2 (ac) 2 e- ? Cu (s)
- Polo - Zn (s) ? Zn2 (ac) 2 e-
- R. redox Zn (s) Cu2 (ac) ? Zn2 (ac) Cu (s)
- El potencial o fem de la pila es Eo 1,10 v
?E pila Eºcátodo - Eº ánodo, siendo ambos
potenciales de reducción.
4
Ecuación de Nerst indica la dependencia del
potencial del electrodo con la concentración.
- E Eº 0,059 log reactivos
- n productos
- Ej calcular ?E pila Zn Cu2 ? Zn2 Cu,
siendo la solución de Zn2 0,1 M y la de Cu2
0,01 M - ?E pila E cátodo - E ánodo
- De acuerdo a los Ereducción sabremos cuál es el
cátodo y cuál es el ánodo - electrodo de Cu , Cu2 (reactivos) 2e-?Cu
(productos) Eº 0,34 V - Ecobre Eº (0,059/2) log Cu2 0,34 V
(0,059/2) log 0,01 0,28 V - Y el electrodo de Zn es el ánodo, para la
reacción Zn2 2e- ?Zn , Eº -0,76 V - E Eº (0,059/2) log Zn2 -0,76 (0,059/2)
log 0,1 -0,79 V por lo tanto es el ánodo, - Zn2( producto) 2e- ?Zn (reactivo)
- ?E pila E cátodo - E ánodo 0,28 (-0,79)
1,07 V - O en forma equivalente
- ?E pila ?Eºpila 0,059 log reactivos
0,34 (-0,76) ( 0,059/2) log Cu2/Zn2 - n
productos
5
Otras reacciones espontáneas (pilas)
Fe2 2e- ?Fe
óxido Fe2O3 . x H2O , es soluble en agua.
La Oxidación se produce en el polo - (ánodo)
será el electrodo que tiene menor potencial de
reducción. Fe?Fe2 2e- La Reducción se produce
en el polo (cátodo) será el electrodo que
tiene mayor potencial de reducción O2 4H 4
e- ? 2 H2O
6
El hierro no sufre corrosión en aire seco y/o
agua libre de oxígeno. Se corroe más rápidamente
en soluciones iónicas y a bajos pH(del
H2CO3) RELACIONADO CON LA CALIDAD DEL AGUA
7
Protección por ánodo de sacrificio Se oxida el
metal con menor potencial de reducción, el menos
noble.
8
(No Transcript)
9
Hidrógeno Generalidades propiedades y
aplicaciones ISÓTOPOS IGUAL NRO ATÓMICO,
DISTINTO PESO ATÓMICO H 1 p, 1e- (Pat 1)
D 1p, 1e-, 1 neutrón (Pat 2) T 1 p,
1e-, 2 neutrones (Pat 3) Los dos últimos
isótopos se forman en los procesos
radiactivos. el hidrógeno, Reacciona con la
mayoría de los elementos, formando compuestos
binarios llamados hidruros , ya sea
metálicos( i ónicos) o no metálicos
(covalentes) El uso del hidrógeno se centra en
las fábricas de margarinas o grasas vegetales,
que se obtienen por hidrogenación de aceites
vegetales . Obtención del hidrógeno Los
ácidos son descompuestos por metales activos
(alto potencial de oxidación), liberándose
hidrógeno gaseoso. Por ejemplo, el ácido
clorhídrico con cinc metálico
Zn 2HCL? H2 ZnCl2 Ciertos metales muy
activos, como el sodio y el potasio, reaccionan a
temperatura ambiente con el agua, l 2
H2O 2 Na ? 2 Na(OH) H2 Otros metales
menos activos, como el hierro, a temperatura de
600ºC y con vapor de agua 2 Fe 6
H2O?2 Fe(OH)3 3 H2 Los hidruros de sodio,
potasio y calcio son también descompuestos, pero
en frío, por el agua 2 H2O CaH2
?Ca (OH)2 H2 La electrolisis del agua también
forma hidrógeno y oxigeno El carbón,
incandescente y en contacto con vapor de agua,
desprende hidrógeno junto con monóxido de
carbono. H2O C ?
H2 CO
10
OXÍGENO
Generalidades y aplicaciones El aire, lo contiene
en un 20,94 de su volumen, siendo los restantes
gases, el nitrógeno (78.09) y, el resto, una
mezcla de gases formada por, dióxido de carbono,
helio, neón, criptón y xenón. Se consideran
valores normales, es decir, a nivel del mar, dado
que la altura disminuye el porcentaje de
oxigeno. El oxigeno se halla combinado con
otros elementos, siendo su principal producto el
agua, que cubre casi las tres cuartas partes de
la corteza terrestre. Combinado con los metales
forma óxidos básicos (óxido de alumninio, óxidos
de hierro, etc) Con los no metales forma oxidos
ácidos o anhídridos,( dióxido de silicio, dióxido
de carbono , etc). Industrialmente, la manera de
obtener oxigeno es a partir del aire. Consiste
en dos etapas bien definidas primero, compresión
y expansión del aire, provocando un gran descenso
de la temperatura (-200ºC) y, de esta manera, se
forma el aire liquido. La segunda etapa, es la
destilación fraccionada, donde, al destilar, se
separan totalmente los dos componentes
fundamentales, debido a que poseen puntos de
ebullición diferentes, el oxigeno -183ºC y el
nitrógeno -195ºC.
11
Industrialmente, la manera de obtener oxigeno es
a partir del aire. Consiste en dos etapas bien
definidas primero, compresión y expansión del
aire, provocando un gran descenso de la
temperatura (-200ºC) y, de esta manera, se forma
el aire liquido. La segunda etapa, es la
destilación fraccionada, donde, al destilar, se
separan totalmente los dos componentes
fundamentales, debido a que poseen puntos de
ebullición diferentes, el oxigeno -183ºC y el
nitrógeno -195ºC.
El siguiente es un esquema del método de LINDE
para licuar el aire
12
Se utiliza el oxigeno a presión de 150 atmósferas
dentro de cilindros de acero para uso en la
industria metalúrgica (soldadura autógena).
También es usado como propulsante de cohetes y
convenientemente purificador en medicina.
En laboratorio puede obtenerse mediante la
electrolisis del agua débilmente acidulada con
ácido sulfúrico
Propiedades de oxigeno Es un gas incoloro,
inodoro e insípido. Poco soluble en el agua, pero
lo suficiente como para permitir la vida
subacuática. (en ausencia de contaminación) Toda
reacción en la que interviene el oxigeno y un
combustible (solidó, liquido o gaseoso), recibe
el nombre de combustión y, puede ser, completa o
incompleta En ambas, se desarrolla gran cantidad
de calor. Que se produzca un tipo u otro de
combustión, depende de la cantidad de oxigeno
respecto de la del combustible. En exceso de
oxigeno, la combustión es completa pero, si se
halla en defecto, es incompleta. El monóxido de
carbono es una sustancia altamente venenosa.
COMBUSTIÓN COMPLETA COMBUSTIÓN INCOMPLETA
13
Una variable alotrópica del oxigeno es el ozono
(O3), molécula triatómica gaseosa, incolora y de
olor picante, que puede usarse como desinfectante
(en aguas)
Esta reacción requiere de considerable energía,
al rededor de 68000 calorías, y puede ser
suministrada de dos formas energía eléctrica o
energía fotoquímica. La luz ultravioleta del sol
es la responsable de la conversión del oxigeno en
ozono en las capas altas atmosféricas
EN LA ATMÓSFERA Normalmente, el ozono absorve UV
actuando como filtro y regenerándose
UV O3 ?O O2 , O
O2?O3, pero
Destrucción de la capa de ozono Los gases
CFC clorofluorocarbonos liberan Cl por UV
Cl O3? ClO O2 EL Cl
destruye O3, funcionando como catalizador.
ClO O ? Cl O2 NETO O3 O?
2 O2
14
Agua Las 2/3 partes de la superficie terrestre
se halla cubierta por agua (océanos, mares, ríos,
lagos). La atmósfera en cualquier punto
geográfico contiene vapor de agua. En la tierra
el agua se halla en continuo ciclo se evapora,
de los océanos, lagos, y del suelo firme, etc.,
por acción del calor solar. En el ciclo natural,
el agua en forma de vapor, se encuentra en las
nubes, siendo su estado puro, pero, por
distintas circunstancias se impurifica. P.ej Las
aguas que contienen dióxido de carbono atacan a
los carbonatos, tales como las calizas, el
carbonato de hierro (II) etc., formando
bicarbonatos solubles. En la atmósfera, arrastra
los dispersoides, como el polvo atmosférico, y,
también, los microorganismos y, disuelve los
gases del aire. La lluvia limpia la atmósfera y
se torna agresiva. En las corrientes
superficiales o profundas, lava los terrenos,
ejerciendo una triple acción disgregación
reactiva solubilizante. El agua, en forma de
hielo tiene una densidad inferior a la del agua
liquida (el hielo flota sobre el agua líquida)
por la formación del puente de H en agua
líquida. El ser humano necesita el agua como
medio vital y posee una cantidad variable de
65-70 de agua en el cuerpo. Cuando el agua es
pura, es inodora, incolora e insípida. El calor
especifico del agua (1 cal/gr. ºC) es muy alto,
es por ello, que puede absorber gran cantidad de
calor sin aumentar mucho su temperatura, es por
este motivo, que se utiliza como refrigerante en
motores de combustión interna. Propiedades de
las sustancias Por qué en un auto se usa nafta,
aceite , aguay no solamente agua?
15
(No Transcript)
16
- La molécula del agua es covalente polar y se
orienta en un campo eléctrico, disminuyendo en 80
veces la intensidad del mismo, por eso, que el
agua es un dieléctrico de constante igual a 80.
El agua tiene gran capacidad disolvente
(disolvente universal) y en ella, gran cantidad
de sales, al disolverse se rodean de moléculas de
agua, separándose los iones de la sal, que a su
vez resultan rodeados de moléculas de agua
(solvatación) haciendo, de esta manera, que los
iones se muevan dentro de la solución en forma
independiente, puesto que ha disminuido la fuerza
de atracción iónica y, así, la solución formada
es capaz de conducir la corriente eléctrica, es
por ello que las soluciones acuosas de estas
sustancias se llama electrolitos. Los océanos y
los mares son fuertes inagotables de elementos
como sodio, magnesio, bromo, que se encuentran
disueltos como sales y donde son extraídos con
fines industriales. - RECORDAR REGLA SOLUBILIDAD
- Las sustancias más comúnmente encontradas en las
aguas naturales se pueden clasificar en - Sustancias solubles cloruros, bromuros, yoduros,
fluoruros, sulfatos, nitratos, carbonato ácidos
(bicarbonatos) de sodio, potasio, magnesio,
calcio, manganeso, hierro, etc. - Sustancias insolubles sílice coloidal (SiO2),
arcillas coloidales (SiO2 Al3O3), oxido férrico
coloidal, alúmina coloidal. - Gases disueltos oxigeno, nitrógeno, dióxido de
carbono, metano, ácido sulfhídrico, etc. - Materias orgánicas microorganismos, restos de
animales y/o vegetales, plantas y animales
acuáticos, etc. - La agresividad físico-química de los compuestos
vistos, puede expresarse de la siguiente forma - Gases O2 (corrosivos), CO2 (corrosivo y ácido)
CO2 H2O? H2CO3 - Sustancias inorgánicas Cl- (corrosivo), Ca2 y
Mg2 (dureza incrustaciones), Na, K, SO4-2
(formadores de espuma en calderas), CO3H-
(alcalinidad) - El agua de lluvia es el agua natural más pura,
pues solamente contiene como termino medio 0,003
de sólidos y pequeñas cantidades de CO2 y O2
disueltos.(PERO EXISTE LA LLUVIA ÁCIDA) - El agua de mar contiene aproximadamente 3,5 de
sales disueltas de las cuales el 2,5 corresponde
a ClNa y el resto sales de K, Ca2, Mg2, etc.
17
Aguas duras Se llama así a las aguas que
contienen exceso de sales solubles de calcio y de
magnesio. Estas aguas, no forman espuma con el
jabón y endurecen o petrifican a los vegetales,
especialmente a las legumbres, durante su
cocción. El cortado del jabón se produce porque
se forman sales de calcio y/o magnesio que son
insolubles en agua. Los jabones, son sales de
ácidos grasos, sódicas o potásicas, solubles en
agua. Las legumbres, en su cáscara, contienen
ácido oxálico, se produce oxalato de calcio y/o
magnesio que endurece el tegumento, y comienza la
petrificación, e impide su normal cocimiento. La
presencia de cantidades moderadas de calcio y
magnesio en las aguas no es nociva, es benéfica,
pues proporciona al organismo sales
indispensables para el metabolismo. Según su
dureza, se pueden clasificar las aguas,
expresando la concentración en ppm (partes por
millón) de sales de calcio y de magnesio (dureza
total), como carbonato de calcio
Partes por millón 1 ppm 1/
1.000.000
1 gr 1000 mg
18
- Las aguas se clasifican en
- Aguas blandas menos de 50 ppm de CO3Ca
- Aguas semiduras entre 50 y 150 ppm de CO3Ca
- Aguas duras entre 150 y 300 ppm de CO3Ca
- Aguas extra-duras mas de 300 ppm de CO3Ca
Otra clasificación de las aguas se realiza en
base al tipo de dureza. La dureza total
corresponde a dos durezas la temporaria y la
permanente. Se llama dureza temporaria, a
aquella producida por las sales bicarbonato de
calcio y de magnesio. Se denomina temporaria
Porque dichas sales se descomponen a la
temperatura por sobre 80ºC, según las siguientes
ecuaciones
La dureza permanente es producida por las sales
SO4Ca, SO4Mg, Cl2Ca, Cl2Mg, (NO3)2Ca,(NO3)2Mg. Se
denomina dureza permanente porque no se
descompone a la temperatura de ebullición del
agua, pero, dentro de una caldera, con presión y
temperatura superiores a 100ºC, el SO4Ca
disminuye la solubilidad con aumento de la
temperatura al igual que el SO4Mg.
19
Resumen La dureza del agua se clasifica en
- I) Dureza temporaria es la que desaparece por
calentamiento, es debida a los bicarbonatos de Ca
y Mg. - II) Dureza permanente no es eliminada por el
calentamiento, es debida a otras sales solubles
de Ca y Mg ( cloruros , sulfatos, nitratos). - Las incrustaciones debidas a la dureza
permanente son originadas principalmente por el
CaSO4 (disminuye la solubilidad con el aumento de
la temperatura). - III) Dureza total dureza temporaria más dureza
permanente.
20
- Se llaman incrustaciones al recubrimiento que se
produce en el interior de los tubos conductores
de agua de caldera, y radiadores. - Las sustancias incrustantes son carbonato de
calcio, sulfato de calcio, cloruro de calcio,
carbonato de magnesio, sulfato de magnesio,
cloruro de magnesio, sílice (dióxido de silicio) - Se puede clasificar las incrustaciones en
- Blandas recubrimientos de carbonato de calcio y
de magnesio provenientes de la dureza temporaria,
y pueden ser removidas por acción de
desincrustantes. - Duras Se producen principalmente por sulfatos de
calcio y magnesio, presentan aspecto vidrioso y - se adhieren firmemente a las paredes de los tubos
de calderas, principalmente, en las zonas de
mayor temperatura, debido a la disminución de sus
solubilidades con el aumento de esta. - Las incrustaciones, producen inconvenientes muy
serios en las calderas y en los sistemas
generales de refrigeración, debido a que,
disminuye el rendimiento térmico de la caldera,
por efecto de la acción aislante térmica de la
costra de incrustación. Además disminuye el
efecto refrigerante, al no hallarse esta en
contacto directo con el tubo, por efecto de la
incrustación, el tubo se calienta en esa zona
hasta el rojo, disminuyendo su resistencia
mecánica, si por vibraciones de la caldera se
produce una fisura en la incrustación, el agua
caliente se filtra por ella y, al ponerse en
contacto con el tubo caliente, se evapora
bruscamente, ejerciendo una presión que provoca
la dilatación del tubo, el cual, al llegar al
limite de resistencia, explota.
Agua caliente
vapor
21
-
Usos del agua - Agua de uso industrial Debe ser purificada con el
objeto de minimizar la corrosión y la dureza. - La dureza puede ser eliminada por varios
procesos - )
Uso industrial calderas, fábricas de productos químicos, fabricas de papel, preparación de hormigón, refrigeración, condensación. Uso no industrial alimentación, higiene, riego.
Pretratamientos Cal y soda Intercambio iónico Tratamientos internos Caldera de baja presión se agregan desincrustantes (carbonato de sodio, aluminato de sodio, fosfato diácido de sodio) Caldera de alta presión se agregan desincrustantes (aluminato de sodio y fosfato diácido de sodio)
La Oxidación se produce en el polo - (ánodo)
será el electrodo que tiene menor potencial de
reducción. Fe?Fe2 2e- La Reducción se produce
en el polo (cátodo) O2 4H 4 e- ? 2 H2O
22
Proceso Cal-Soda Se utiliza cal (hidróxido de
calcio) y soda (carbonato de sodio cristal). El
tratamiento se realiza en frío o en caliente, en
aparatos cercanos a la zona de caldera. Las
sustancias insolubles que se forman se separan
por decantación. Acción del hidróxido de
calcio el hidróxido de calcio, elimina la dureza
temporaria, el dióxido de carbono disuelto y
transforma las sales de magnesio en hidróxidos de
magnesio.
- Acción del carbonato de sodio
elimina la dureza permanente.
23
El tratamiento se completa con el agregado de
aluminato de sodio, que favorece la decantación
de los insolubles formados. VENTAJAS
CAL-SODA El proceso Cal-Soda, en caliente,
aumenta la velocidad con que reacciona el
hidróxido de calcio, disminuye la corrosión, por
la disminución de la solubilidad del oxigeno (a
mayor temperatura, menor solubilidad) DESVENTAJAS
CAL-SODA
produce aguas libres de durezas, pero con alto
contenido salino de sales solubles de sodio, con
lo cual, no es conveniente el uso en calderas de
alta presión, por la formación de espuma que
produce
24
Procesos con resinas intercambiadoras En el año
1935, Adams y Holmes lograron preparar las
primeras resinas de intercambio, actualmente
basadas en polímeros. orgánicos. . Se llaman así,
a aquellos materiales insolubles que poseen
iones, que fácilmente se intercambian con otros
iones presentes en el líquido, sin que se
produzca ninguna otra modificación física en su
estructura. Las resinas usadas son
intercambiadoras cationicas, que se caracterizan
por cambiar los iones sodio, por los iones calcio
y magnesio. Los fenómenos que se producen
durante el intercambio iónico se relacionan con
los procesos de adsorción, considerando que el
proceso se realiza sobre la superficie de un
producto no poroso. La capacidad de intercambio
de una determinada resina esta determinada por el
tamaño molecular de la misma, la valencia de los
iones a intercambiar y, la concentración de los
mismos. Generalmente, en soluciones diluidas, la
capacidad de intercambio aumenta con el aumento
de la valencia de los iones.
Los aniones ofrecen la siguiente capacidad de
intercambio
Las resinas de intercambio se las puede
clasificar en dos grandes grupos Catiónicas y
Aniónicas Las Catiónicas, a su vez, pueden ser
ciclo ácido o ciclo sodio Las Aniónicas
pueden ser básicas fuertes o básicas débiles
25
Las resinas Catiónicas pueden disociarse así
Ciclo ácido Ciclo sodio
Las resinas aniónicas pueden disociarse así
Intercambio de iones Resina cationica
Resinas aniónicas
26
INTERCAMBIA Na por H (catiónica)
27
La eliminación de las sales de calcio y magnesio
de las aguas duras, se realiza en columnas que
contienen las resinas de intercambio ciclo sodio,
no se usa ciclo ácido porque disminuiría el PH
del agua ablandada por incorporación de protones
al agua. El proceso dinámico, consiste en hacer
circular, a través de la columna rellena con
resina sódica, el agua en tratamiento ya sea por
flujo o por gravedad o en sentido inverso. Se
llama influente al liquido que entra en la
columna. Se llama elusión a la eliminación de
iones adsorbidos. Se llama eluente a la
solución usada para la elusión. La velocidad de
flujo del líquido que pasa por la columna debe
ser de 2ml por minuto.
Cuando, a través de la resina circulo cierta
cantidad de litros de agua dura, la capacidad de
intercambio iónico disminuye, hasta que la resina
deja de adsorber iones calcio y magnesio,
apareciendo en el efluente los iones contenidos
en el influente. En ese momento se llega al
denominado punto de ruptura en donde, la resina
esta agotada, siendo necesaria su regeneración.
Se llama, regeneración de la resina, al proceso
por el cual, se transforma a la resina agotada en
resina activa, debido a que el proceso es
reversible
28
La regeneración se realiza pasando, a través
del lecho de la resina, una solución de cloruro
de sodio 5-8 p/v. Se producen las siguientes
reacciones
29
Agua desmineralizada Se llama así, a la que se
obtiene, eliminando todos los iones positivos y
negativos, así como también, el dióxido de
silicio y el dióxido de carbono, utilizando ambas
resinas de intercambio, la aniónicas y la
cationica. El agua desmineralizada se diferencia
del agua destilada, en que esta última se obtiene
por el proceso de destilación (evaporación-condens
ación). Las cualidades del agua desmineralizada
es que presenta una resistencia mayor que la
destilación primaria del agua.
30
Las resinas de intercambio que se utilizan pueden
estar en lechos separados o en lecho mixto o
mezclados. En el primer caso, el agua se hace
pasar, primero a través de una columna
conteniendo la resina cationica y, luego, el agua
que sale de esta, se hace pasar a través de la
segunda columna conteniendo la resina aniónica.
En el proceso de lecho mezclado, una columna
esta rellena de ambas resinas perfectamente
mezcladas.
- Se llevan a cabo las siguientes reacciones
químicas - La resina cationica elimina cationes Mg Ca
Na etc. En lugar del catión aparece H - La resina aniónica elimina aniones Cl-, (SO4)--,
CO3H-, etc. En lugar del anión aparece OH-
31
Las velocidades de flujo, en las dos columnas,
deben ser de 1 a 2 ml por minuto. El proceso se
puede controlar midiendo la conductividad del
agua que va eluyendo de la segunda columna,
siendo el PH de la misma 7. La resina aniónica,
una vez agotada, se regenera haciéndole pasar una
solución de HONa al 5 p/v y, la catiónica, con
H4SO4 al 5 p/v
32
-
Agua para uso no industrial.
Agua potable - Se define como agua potable la que es apta para
la alimentación. El análisis bacteriológico no
debe acusar la presencia de gérmenes patógenos. - Podrán contener como máximo 1,5gr de sales
totales por litro, el PH no deberá ser superior a
7,2 y, no deberá contener más de 0,5 ppm de cloro
libre. - El agua de río es un líquido turbio que contiene,
sustancias solidas en suspensión de naturaleza
coloidal, compuesta principalmente por, arcillas,
- materia orgánica en descomposición, gérmenes
patógenos, y no patógenos, algas, sales, gases
disueltos. Entre los gérmenes patógenos se
encuentran el bacilo colli - Para potabilizar el agua se puede realizar las
siguientes etapas - Coagulación
- Decantación
- Alcalinización
- Filtración
- Cloración
- Ultima alcalinización
- El agua proveniente del río, se mezcla con
sulfato de aluminio y cloro. Se agita durante un
tiempo produciéndose las siguientes reacciones
33
Las pequeñas partículas de hidróxido de aluminio
que se forman, por sus propiedades adsorbentes,
fijan las micelas de las arcillas coloidales y,
la reacción con el cloro, destruye
microorganismos. Luego, el agua, pasa a piletas
acondicionadoras donde permanecen 30 minutos con
agitación lenta, manteniendo el hidróxido de
aluminio en suspensión, y se forma el llamado
floc que, al aumentar de peso, produce la
decantación. El ácido sulfúrico, formado por
hidrólisis (ver ecuación química), produce la
eliminación de la dureza temporaria e impide la
proliferación de gérmenes. (PH6)
34
Luego, el agua, pasa a los alcalinizadores,
donde se agrega lechada de cal (HO)2Ca para
elevar el PH de 6 a 7,2 produciéndose la
neutralización del exceso de ácido sulfúrico.
H2SO4 Ca(OH)2 ? CaSO4 2
H2O Luego, el agua neutralizada, se pasa por
filtros de arena y grava que retiene los sólidos.
De ahí, pasa, por un canal colector, hacia los
cloradores donde se agrega más cloro en forma
dosificada Cl2 2 H2O
? ClOH ClH
ClOH ? HCl O El oxigeno naciente (O)
producido, esteriliza el agua eliminando los
microorganismos. Finalmente el agua pasa al
decantador de cal donde se agrega (HO)2Ca para
elevar el PH de 8,2 a 8,4 con el fin de proteger
las redes de distribución, válvulas, etc.
Finalmente el agua se almacena en cisternas para
luego realizar la distribución domiciliaria.