ESTRUCTURA DEL TOMO - PowerPoint PPT Presentation
1 / 31
Title:
ESTRUCTURA DEL TOMO
Description:
Elementos son sustancias que no pueden ser descompuestas en sustancias m s simples ... El yodo gaseoso al ponerse en contacto con el vidrio de reloj, el cual est fr o ... – PowerPoint PPT presentation
Number of Views:183
Avg rating:3.0/5.0
Title: ESTRUCTURA DEL TOMO
1
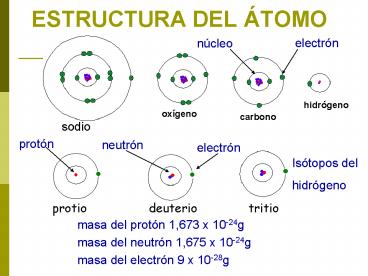
ESTRUCTURA DEL ÁTOMO
electrón
núcleo
hidrógeno
oxígeno
carbono
sodio
protón
neutrón
electrón
Isótopos del hidrógeno
protio deuterio
tritio
masa del protón 1,673 x 10-24g masa del
neutrón 1,675 x 10-24g masa del electrón 9 x
10-28g
2
ELEMENTO
- Antes de Dalton
- Elementos son sustancias que no pueden ser
descompuestas en sustancias más simples - Dalton
- Elementos son sustancias formadas por átomos
idénticos - Definición Moderna
- Elementos son sustancias formadas por átomos que
tienen exactamente la misma carga positiva en el
núcleo. Es decir - Todos los átomos de un mismo elemento tienen el
mismo Número Atómico
3
TABLA PERIÓDICA
No Metales
Metales
Metaloides
4
Metaloides
5
ENLACE IÓNICO
Formación del Cloruro de Sodio, a partir a la
reacción entre el Sodio y el Cloro
6
ENLACE COVALENTE
7
DEFINICIÓN DE MATERIA
Materia es cualquier cosa que tiene masa y que
ocupa un espacio. La materia es de lo que están
hechos todos los objetos materiales
Cuáles de los incisos siguientes constituyen un
ejemplo de materia? a) hierro b) amor c)
aire d) fuego e) gasolina
8
COMPARACIÓN DE MASAS
La Materia tiene masa. La masa es una magnitud
relacionada con la cantidad de materia que tiene
un objeto, es decir podemos medirla.
9
DIFERENTES PUNTOS DE VISTA EN EL ESTUDIO DE LA
MATERIA
Representación símbolos, ecuaciones, cálculos
Macroscópico tangible, visible, utilizable
Pensamiento del Docente
Microscópico molécula, átomos, enlaces
10
ESTUDIO DE LA MATERIA A NIVEL MACROSCÓPICO
Estados de Agregación
H2O2 H2O
Composición
Reacciones Químicas y Cambios Energéticos que las
acompañan.
Estructura
11
Estructura cristalina del Diamante
Estructura cristalina del Grafito
12
CLASIFICACIÓN DE LA MATERIA
Cambios físicos
Sustancias puras
Mezclas
Cambios químicos
Compuesto
Homogéneas
Heterogéneas
Elemento
- polvo
- arena
- vinagreta
- sal
- bicarbonato de sodio
- azúcar
- refresco
- gasolina
- aire
- oxígeno
- oro
- hierro
13
PROPIEDADES DE LA MATERIA
Propiedades Físicas Aquellas que pueden ser
observadas o medidas sin que ocurra cambio en la
composición química de la sustancia. Cambio
Físico Altera alguna propiedad física.
Propiedades Químicas Aquellas que pueden ser
observadas o medidas dependiendo de la habilidad
de las sustancias para reaccionar y formar una
nueva sustancia que tiene propiedades diferentes.
Cambio Químico Altera la composición química de
la sustancia.
14
ESTADOS FÍSICOS DE LA MATERIA
- Las sustancias son rígidas
- Tienen forma definida
- El volumen no cambia con la presión o la
temperatura
Estado sólido
- Las sustancias adoptan la forma del recipiente
que los contiene - Los líquidos son difíciles de comprimir
Estado líquido
- Son menos denso que los líquidos y sólidos
- ocupan todo el volumen del recipiente que los
contiene - Son capaces de expandir y comprimir fácilmente
Estado gaseoso
15
ESTADOS DE AGREGACIÓN DE LA MATERIA
Estado líquido
Estado sólido
Estado gaseoso
16
CAMBIO FÍSICO
Deposición
Sublimación
Vaporización
Condensación
Fusión
Cristalización
17
SUBLIMACIÓN Y SOLIDIFICACIÓN DEL YODO
- Cuando se calienta el yodo sólido en un vaso de
precipitados, se forma un gas violeta, que
corresponde a moléculas de yodo libres. El yodo
gaseoso al ponerse en contacto con el vidrio de
reloj, el cual está frío porque tiene un cubo de
hielo, se deposita en forma de cristales de yodo.
18
SEPARACIÓN DE MEZCLAS
Papel de filtro
La tinta de los marcadores es un ejemplo de
mezcla homogénea, que contiene pigmentos de
diversos colores.
Alcohol
Línea horizontal de marcador
19
Manifestación de los Electrolitos
20
CONCEPTO DE ELECTROLITOS
La gran diferencia entre el cloruro de sodio y el
azúcar, que se evidencia cuando se enciende el
bombillo, consiste en que el cloruro de sodio
conduce la electricidad cuando se disuelve en el
agua, en cambio la sacarosa no. De aquí que Las
sustancias que conducen la electricidad cuando se
disuelven en agua ó cuando se funden, son
llamadas ELECTROLITOS. Aquellas que no lo hacen,
son llamadas NO ELECTROLITOS
El cloruro de sodio es un electrolito
El azúcar es un no electrolito
21
CARACTERÍSTICAS DE LOS ELECTROLITOS
- Cuando el cloruro de sodio se disuelve en el
agua, la molécula (Na Cl-) se separa en sus
iones. Mientras que el azúcar, al disolverse en
el agua, todos los átomos que conforman la
molécula permanecen unidos y no existe la
posibilidad de formación de iones . - La composición química de estas dos sustancias o
más exactamente, las fuerzas que mantiene unida
la materia en ambos casos es diferente.
22
IONES SODIO Y CLORURO HIDRATADOS
Cuando se disuelve el cloruro de sodio en agua,
cada uno de sus iones Na y Cl- se rodea de
moléculas de agua, porque de esta manera
adquieren una situación de más estabilidad, la
cual se manifiesta muchas veces por un
desprendimiento de energía en forma de calor.
23
MOLÉCULA DE AZÚCAR HIDRATADA
Cuando se disuelve el azúcar en el agua, la
molécula de azúcar se rodea de moléculas de agua.
Las partículas de azúcar no se separan en iones,
porque las fuerzas que unen sus átomos son muy
fuertes y el sistema es más estable cuando la
molécula permanece unida y rodeada de moléculas
de agua.
24
CLASIFICACIÓN DE LAS SUSTANCIAS
Electrolitos
No Electrolitos
Moléculas de agua
Iones
Moléculas
No hay iones presentes en solución
Hay iones presentes en solución
25
ELECTROLITO FUERTE
La sustancia, en solución,está totalmente
separada en sus iones. Son electrolitos fuertes
el ácido clorhídrico (componente activo del Ácido
Muriático), el hidróxido de sodio (componente
activo de destapadores de cañería).
26
ELECTROLITO DÉBIL
La sustancia, en solución, está parcialmente
separada en sus iones. Son electrolitos débiles
el ácido acético (principio activo del vinagre),
el ácido cítrico, presente en las frutas
27
ELECTROLITOS
- Las sustancias azúcar, ácido cítrico y ácido
acético, no electrolitos o electrolitos débiles,
pertenecen a la familia de los compuestos
orgánicos. - Las sustancias cloruro de sodio, ácido
clorhídrico e hidróxido de sodio, todas
electrolitos fuertes, pertenecen a la familia de
los compuestos inorgánicos - Por tanto, podríamos suponer que en la mayoría de
los casos 1) las sustancias orgánicas se
comportan como no electrolitos o electrolitos
débiles 2) las sustancias inorgánicas se
comportan como electrolitos fuertes
28
FUERZAS QUE MANTIENEN UNIDA A LA MATERIA
- Tipos de Fuerzas Intermoleculares
- Dipolo Dipolo
- Enlace Hidrógeno
- Ión Dipolo
- Ión Ión
- Las Fuerzas Intermoleculares afectan
propiedades físicas tales como - Punto de Fusión
- Punto de Ebullición
- Presión de vapor
- Viscosidad
- Tensión Superficial
29
TRANSFERENCIA DEL CONCEPTO
Normalmente los elementos que se encuentran en
los fluidos presentes en el cuerpo humano están
bajo la forma de moléculas neutras, como por
ejemplo las proteínas, o bajo la forma de iones
cargados eléctricamente. Estando la presencia de
cargas o no directamente relacionado con su
función en el organismo. Podríamos por ejemplo
citar la importancia de los electrolitos sodio y
potasio (Na y K)en la transmisión de los
estímulos nerviosos al cerebro.
30
ESTRUCTURA DE UNA NEURONA
Cuando el sistema nervioso recibe un estímulo, el
procesamiento de la información se efectúa a
través de las Neuronas, La señal nerviosa es
recibida por la Dendrita y recorre el Axón.
31
ESTRUCTURA DE UNA NEURONA
El Axón mantiene un equilibrio químico entre
iones potasio en el interior y iones sodio en el
exterior. Cuando la célula nerviosa recibe un
estímulo, hay un intercambio de iones a través de
la Mielina generándose una señal eléctrica que se
desplaza a lo largo del Axón.