AZ S-MEZO ELEMEI PowerPoint PPT Presentation
Title: AZ S-MEZO ELEMEI
1
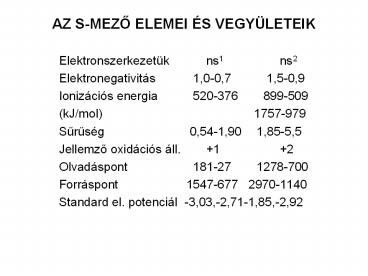
AZ S-MEZO ELEMEI ÉS VEGYÜLETEIK
- Elektronszerkezetük ns1 ns2
- Elektronegativitás 1,0-0,7 1,5-0,9
- Ionizációs energia 520-376 899-509
- (kJ/mol) 1757-979
- Suruség 0,54-1,90 1,85-5,5
- Jellemzo oxidációs áll. 1 2
- Olvadáspont 181-27 1278-700
- Forráspont 1547-677 2970-1140
- Standard el. potenciál -3,03,-2,71-1,85,-2,92
2
AZ S-MEZO ELEMEI ÉS VEGYÜLETEIK
- Ion r(pm) r(pm) n(H2O) ?Hhidr. Ion
r2(pm) ?Hhidr. - hidrat. kJ/mol
kJ/mol - Li 76 340 25 519 Be 45
2494 - Na 102 276 17 406 Mg 72
1921 - K 138 232 11 322 Ca 100
1577 - Rb 152 228 ? 293 Sr 118
1443 - Cs 167 228 10 264 Ba 135
1305 - A Li, illetve a Be és a Mg sajátságai kissé
eltérnek a csoport többi tagjáétól -kicsiny
méret ? nagy felületi töltéssuruség ? eros
polarizálóképesség ? kovalens kötési hajlam (pl.
rendkívül erosen kötött hidrátburok). - A Li és a Mg illetve a Be és az Al hasonlósága
átlós rokonság (hasonló méret, illetve még
hasonlóbb felületi töltés-suruség.
3
AZ ALKÁLIFÉMEK JELLEMZÉSE
- Elem r(atom) I1 I2 Op,C
Fp,C e, (V) EN - (pm) (kJ/mol)
- Li 152 520 7296 181
1347 -3,02 1,0 - Na 186 496 4563 88
881 -2,71 0,9 - K 227 419 3069 64
766 -2,92 0,8 - Rb 248 403 2640 39
688 -2,99 0,8 - Cs 265 376 2260 29
705 -3,02 0,7 - Fr 375
0,7 - H gt30 1310 -259
-253 0,0 2,1 - Cl 99 1255 -101
-35 1,36 3,0 - A fizikai és a kémiai tulajdonságok a csoportban
lefelé túlnyomórészt monoton változnak.
4
AZ ALKÁLIFÉMEK JELLEMZÉSE
- Fizikai tulajdonságok
- -Kis suruséguek, puhák, vághatóak, alacsony op.
és fp., jó ho és elektromos vezetoképesség, nagy
atom-és ionsugár - -Gozeik egyatomosak
- -Külso héjon levo elektronjuk könnyen
gerjesztheto ? jellemzo színure festik a lángot - Li vörös Rb sötétvörös
- Na sárga Cs kék
- K fakóibolya (nem ugyanazon átmenetre
vonatkoznak) - -Más fémekkel ötvözhetok, higanynyal amalgámot
képeznek - -Cseppfolyós ammóniában (amminokban) jól oldódnak
5
AZ ALKÁLIFÉMEK OLDÓDÁSA CSEPPF. NH3-BAN
- Oldható fémek alkáli fémek és Ca, Sr, Ba, Eu, Yb
- Híg oldat
- M (xy)NH3 M(NH3)y e(NH3)x-
- Kék színu, vezeti az elektromos áramot,
paramágneses ? szolvatált elektron - Töményebb oldat
- 2 e(NH3)x- e2(NH3)z2- (2x-z)NH3
- Narancssárga oldat, a szolvatált elektron
párosodása ? a paramágnesség csökken - Tömény oldat
- 2 M(s) M(NH3)y Me2(NH3)z-
- A szolvatált kation stabilizálása
- alkidok (Msolv)(Msolv-)
- elektridek (Msolv)(esolv-)
- Amid-képzodés 2Na 2NH3 2NaNH2 H2
- Fény vagy átmenetifém-ionok (pl. Fe3)
katalizálják.
6
AZ ALKÁLIFÉMEK KÉMIAI TULAJDONSÁGAI
- Igen reakcióképes elemek, a reakcióképesség a
csoportban lefelé no. - Eros redukálószerek
Reakció Megjegyzés
M H2O ? MOH H2 Hidroxidjaik a legerosebb ismert bázisok
Li O2 ? Li2O Monoxid képzodik Li esetében (és kismértékben Na-nál)
Na O2 ? Na2O2 Peroxid képzodik Na esetében (és kismértékben Li-nál)
K O2 ? KO2 Szuperoxid képzodik K, Rb, Cs esetében
M H2 ? MH Sószeru hidridek
Li N2 ? Li3N Nitridet csak a Li képez
M NH3 ? MNH2 Mindegyikük képez amidokat
M X ? M3X Mindegyikük képez foszfidokat/arzenideket/antimonidokat
M X ? M2X Mindegyikük képez szulfidokat/szelenideket/telluridokat
M X ? MX Mindegyikük képez halogenideket
M C ? M2C2 csak a Li és Na, a többi intersticiális karbidokat képez
7
AZ ALKÁLIFÉMEK ELOFORDULÁSA, ELOÁLLÍTÁSA
- Elofordulás csak vegyületeikben, 1 oxidációs
állapotban - NaCl-kosó, NaNO3-chilei salétrom,
- Na2SO410H2O-glaubersó, Na2CO310H2O-szóda,
- NaHCO3, Na2B4O5(OH)48H2O-bórax
- KCl-szilvin, KClMgCl26H2O-karnallit
- K2CO3-hamuzsír,
- Szilikátok (tengervíz)
- Li, Rb, Cs, ritka elemek
- Na,K élovilágbeli elofordulásuk (a K szélesebb
körben) - Eloállítás
- Halogenidjeik olvadék-elektrolízise (grafit anód,
acél katód) - K,Rb,Cs olvadék halogenidek redukciója Na-mal
8
AZ ALKÁLIFÉMEK FELHASZNÁLÁSA
- Redukálószer, víztelenítoszer, hutofolyadék
(nukleáris reaktorokban), galvánelemek (Li-anód,
polivinil-piridin-I2-katód, LiI elektrolit),
ötvözoanyag (14Li,1Al,85Mg repülogépipar) - Na2CO3 üveggyártás alapanyaga,
- Li2CO3, K2CO3 porcelán- és üveggyártás
adalékanyaga, - NaCl NaOH gyártás alapanyaga, utak sózása
(környezetvédelem!) - NaOCl, Na2O2 fehérítés textil- és papíripar
- KMnO4 fertotlenítoszer, oxidálószer
- KO2 kisegíto oxigénforrás
- Li-sztearát kenocsök adalékanyaga
9
ALKÁLIFÉMHIDRIDEK, HALOGENIDEK
- Ionrácsos vegyületek a rácsenergia a Li?Cs és
F?I irányben csökken - Hidridek fehér színu, bomlékony, magas
olvadáspontú, kemény, vízoldható, vegyületek.
Redukálószerek LiAlH4, NaBH4 (szelektívek) - Halogenidek fehér színu, termikusan stabil,
vízoldható vegyületek. LiF2 dimerek, a Li kis
mérete miatt a H-kötéshez hasonló Li-kötés alakul
ki.
Rácsenergia
Forráspont
Olvadáspont
10
IONRÁCS TÍPUSOK I.AX típusú
NaCl rács
r/r- 0,414 0,733 N6 a kocka csúcsain fel-
váltva vannak az ionok
CsCl rács
r/r- gt 0,733 N8 tércentrált köbös rács
11
IONRÁCS TÍPUSOK II.AX2 típusú
CaF2 rács
SiO2 rács
r/r- gt 0,732 Nk8 Na4 kétszer annyi anion, mint
kation
r/r- lt 0,414 Nk4 Na2
TiO2 rács
CdI2 rács rétegrács
kevésbé ionos, így nem fluorit rácsot képez
r/r- gt 0,732 -0,414 Nk6 Na3 oktaéderes
elrendezodés
12
ALKÁLIFÉM VEGYÜLETEK
- Oxidok, hidroxidok
- M2O, M2O2, MO2 és MO3 összetételuek,
- oxigénnel reagálva Li2O, Na2O2, KO2,
- szuboxidok (Cs, Rb) a fém oxidációs állapota 1
alatt van (fém-fém kötés pl. Cs7O (bronz), Cs4O2
(ibolyásvörös), Cs11O3 (ibolya) - Vízzel bázisokat képeznek
- Li2O H2O 2LiOH
- Na2O2 2H2O 2NaOH H2O2
- 2KO2 2H2O 2KOH H2O2 O2
- NaOH eloállítása NaCl oldat elektrolízise (1)
Pt (vagy grafit) elektródos, - (2) Hg katódos (környezetszennyezés), (3)
membráncellás eljárások
13
ALKÁLIFÉM VEGYÜLETEK
- Szulfidok, poliszulfidok
- M2S, illetve M2Sn (n2,3,4,5,6) összetételuek,
- Li/S, Na/S akkumulátorok
- Oxosavak sói
- Karbonátok, hidrogénkarbonátok (karbonát dimer)
- Solvay féle szódagyártás
- NaCl, H2O CO2 NH3 NaHCO3
NH4Cl - NaHCO3 Na2CO3 H2O CO2 (hevítés)
- üvegipar, füstgázok kénmentesítése
- nitrátok, nitritek robbanószeripar
- foszfátok trisó (vízlágyítás)
- NaOCl (hipó) NaOH oldatba Cl2 gázt vezetnek
- Na2S2O3 (fixirsó) fényképezés
14
ALKÁLIFÉM KOMPLEXEK
- Makrociklusos poliéterek koronaéterek és
kriptándok (a komplex neve kriptát) - Jelentoségük
- -méretviszonytól függo nagy stabilitású és
szelektivitású/specifitású alkálifém-,
alkáliföldfém- és átmenetifém komplexek - -biológiai jelentoségük ionpumpák, modellezése,
szelektív fémeltávolítás - -ionrácsos vegyületek szerves fázisba vitele
(KMnO4 benzolban 18-C-6-tal, extrakció,
fázistranszfer katalízis) - -1987 Nobel díj C.J. Pedersen, D. Cram, J.M.
Lehn
dibenzo-18-korona-6 (18-C-6) kriptánd-222
15
SPECIÁLIS ALKÁLIFÉM VEGYÜLETEK
- Fémorganikus vegyületek
- Elsosorban a Li képez ilyen vegyületeket (kis
ionméret, kovalens kötés képzési hajlam) - R-X 2Li ?R-Li LiCl (éterben)
- termikusan és hidrolitikusan instabilis
vegyületek szerves szintézisekben lehetnek
fontosak, pl. (A vitamin gyártásban) - LiAr CO2 ? ArCO2Li ? ArCOOH LiOH
- 4LiBu CH3-CCH ?Li3C-CCLi 4BuH (? A
vitamin) - Vízben rosszul oldódó alkálifém vegyületek
- Li Li3PO4, Li2CO3, LiF
- Na NaSb(OH)6, NaZn(UO2)3(CH3COO)96,5H2O
- K KClO4, KH-tartarát, K2PtCl6, K3Co(NO2)6,
KB(C6H5)4) - Rb, Cs M(CN)B(C6H5)3
16
AZ ALKÁLIFÖLDFÉMEK JELLEMZÉSE
- Elem r(atom) r(ion) I1 I2 Op,C
Fp,C e, (V) EN - (pm) (pm) (kJ/mol)
- Be 112 45 899 1757
1289 2472 -197 1,5 - Mg 160 72 738 1451
650 1090 -2,36 1,2 - Ca 197 100 590 1145
842 1494 -2,84 1,0 - Sr 215 118 550 1064
769 1382 -2,89 1,0 - Ba 222 135 503 965
729 1805 -2,92 0,9 - Ra 148 509 979
700 1700 -2,92 0,9
- Kis ionizációs energiájuk és elektronegativitásuk
révén a 2 oxidációs állapot elérésére törekednek
?az ionméret kicsi? nagy felületi töltéssuruség - Be,Mg kiugróan kicsiny ionméret, nagy
polarizálóképesség ? kovalens molekulák - Ca-Ra inkább ionos vegyületeket képeznek.
17
AZ ALKÁLIFÖLDFÉMEK JELLEMZÉSE
- Fizikai tulajdonságok
- -Az alkálifémekhez képest szorosabb illeszkedésu
fémes rács és több delokalizált elektron ?
nagyobb suruséguek, keményebbek, magasabb op. és
fp., jó ho és elektromos vezetoképesség, - -Gozeik egyatomosak
- -Külso héjon levo elektronjuk könnyen
gerjesztheto ? jellemzo színure festik a lángot - Be, Mg Sr bíborvörös
- Ca téglavörös Ba fakózöld
- -Cseppfolyós ammóniában (amminokban) jól
oldódnak az NH3 elpárolgásával hexammin komplex
marad vissza, ezek lassan amiddá alakulnak - M(NH3)6 ?M(NH2)2 4NH3 H2
- Vö. az alkálifémek esetén a fém marad vissza.
18
AZ ALKÁLIFÖLDFÉMEK KÉMIAI TULAJDONSÁGAI
- A reakcióképesség a csoportban lefelé no. A Be és
a Mg felületét összefüggo oxidréteg védi. - Oxidjaik képzodéshoje nagy égésükkel nagy
lánghomérséklet érheto el (Mg égése levegon és
CO2-ban) MgKClO3 villanópor
Reakció Megjegyzés
M 2HCl ? MCl2 H2 mindegyikük H2 fejlodésével oldódik savakban
M 2H2O ? M(OH)2 H2 Be vízgozzel, Mg forró vízzel, a többi hideg vízzel
Be NaOH? Na2Be(OH)4 H2 a Be amfoter
2M O2 ? 2MO szabályos oxidoat képeznek
Ba O2 ? BaO2 peroxid képzodik Ba esetében O2 feleslegben
M H2 ? MH2 Sószeru hidrideket képeznek magas T-n (Ca, Sr, Ba)
3M N2 ? M3N2 Nitrideket képeznek magas homérsékleten
3M 2NH3 ? 2M(NH2)2 Mindegyikük képez amidokat
3M 2P ? M3P2 Mindegyikük képez foszfidokat
M X ? MX Mindegyikük képez szulfidokat/szelenideket/telluridokat
M X2 ? MX2 Mindegyikük képez halogenideket
19
AZ ALKÁLIFÖLDFÉMEK ELOFORDULÁSA ÉS ELOÁLLÍTÁSA
- Elofordulás csak vegyületeikben, 2 oxidációs
állapotban, a földkéreg leggyakoribb elemei közé
tartoznak - BeOAl2O3-krizoberill, Be3Al2Si6O12-berill,
(Cr2O3 szennyezés smaragd) - MgCO3-magnezit, CaCO3-mészkö, CaMg(CO3)2-dolomit
- CaSO42H2O-gipsz, Ca3(PO4)2-foszforit, apatit
szilikátok - Sr a Ca kíséroje, SrSO4 celesztit,
- BaCO3-witherit, BaSO4-barit
- Ra csak radioaktív izotópjai vannak (226Ra(a),
t½1600 év Li, Rb, Cs, ritka elemek - Mg, Ca élovilágbeli elofordulásuk (a Mg
szélesebb körben) - Eloállítás
- Halogenidjeik olvadék-elektrolízise (grafit anód,
acél katód) - BeO, BeF2 redukciója Mg-mal
20
AZ ALKÁLIFÖLDFÉMEK ELOÁLLÍTÁSA ÉS FELHASZNÁLÁSA
- Eloállítás
- Mg, Ca vegyületek redukciója Si.mal vagy Al-mal
- szilikotermiás eljárás
- 1. hevítés CaCO3, MgCO3 ? CaO, MgO
- 2. FeSi CaO, MgO FeSi ?Mg Ca2SiO4
Fe - Sr, Ba vegyületek redukciója Al-mal
- Felhasználás
- Be szerkezeti anyag (könnyu, kemény, ellenálló)
ötvözetei Al, Ti, V, Cu (repülogépipar,
rakétatechnika, csapágygyártás, szerszámgépek) - Mg-Al ötvözetek reülogépipar
- Ca-Al ötvözetek (keményíti a fémet)
- Ca, Mg redukálószer
- Sr vegyületek képcsövek üvege, pirotechnika
21
ALKÁLIFÖLDFÉM HIDRIDEK, HALOGENIDEK
- CaH2, SrH2, BaH2 ionosak, (BeH2)n és (MgH2)n
kovalensek és polimerek (háromcentrumos kötés
stabilizálja a fémek elektronhiányát) - (BeCl2)n kovalens polimer (halogenidhíd révén
pótlódik a fém elektronhiánya a többi MX2
vegyület ionos. - BeF2 monomer, vízben jól oldódik, BeF42-
képzodéssel stabilizálódik a molekula, pótlódik a
Be elektronhiánya a többi fém fluoridja vízben
általában nem oldódik CaF2 (HF és F2 forrás) - A többi haligenid ionos vegyület, vízben jól
oldódnak (MgCl2, CaCl2 jégmentesítés, CaCl2/H2O
op -55C, NaCl/H2O op -18C
22
ALKÁLIFÖLDFÉM VEGYÜLETEK
- Oxidok, hidroxidok
- MO ? M(OH)2 bázisképzo oxidok, báziserosség és
oldhatóság a csoportban lefelé no. - Be(OH)2 2OH- Be(OH)42- hasonlóság az
Al- és Zn-hez) - MO oxidjaik ionosak, legfontosabb a CaO (égetett
mész) - CaCO3 (900 C) ? CaO (H2O) ? Ca(OH)2 (oltott
mész) - habarcs Ca(OH)2 SiO2 (homok)
- kötése során CO2-ot vesz fel ?CaCO3 CaSiO3
- MO2 peroxidok (stabilitásuk a kation méretével
no) (pl. BaO2) - 2BaO O2 ? 2BaO2 (H2O2 eloállítása)
- Összetett sóik
- nitrátok vízoldhatóak valamennyi fémnél
- karbonátok, szulfátok vízoldhatósága a
csoportban lefelé csökken - hidrogénkarbonátok (Ca, Mg) változó keménység,
cseppkoképzodés, vízkolerakódás - gipsz 150 C
200 C 1100C - CaSO42H2O?CaSO41/2H2O ? CaSO4 ? CaO
SO3 - foszfátok foszforit, apatitok (lásd foszfor
kémiája)
23
ALKÁLIFÖLDFÉM KOMPLEXEK ÉS FÉMORGANIKUS VEGYÜLETEK
- Komplexek
- Kiemelkedo fontosságúak a koronaéterekkel,
kriptándokkal (méretspecificitás), illetve a Be
és a Mg tetrapirrol vázú vegyületekkel képezett
komplexei - Fémorganikus vegyületek
- A Be és a Mg sok ilyen vegyületet képez, de
néhány Ca, Sr és Ba vegyület is ismert - Grignard reagens (1901 Lyon, 1912 Nobel díj)
- Mg RX ? R-Mg-X (R alkil vagy aril)
- (X Br-, I- esetleg Cl-)
- apoláris oldószerben (pl éterben) poláris
oldószerekben elhidrolizálnak - 2RMgX 2H2O RH Mg(OH)2 MgX2
- Felhasználása szerves szintézisekben oxo
vegyületek, amidok, alkánok eloállítása
24
A GRIGNARD REAGENS
- Összetett egyensúlyi rendszer a halogenidion
hídligandum, illetve a Mg elektronhiányos volta
miatt - Az egyensúlyok helyzete a koncentrációtól, a
halogenidtol, az oldószertol, a homérséklettol
függ. A részecskéket az oldószer (éter) molekulák
szolvatálják.
25
BIOLÓGIAI JELENTOSÉGÜK
- Biológiai fontosságuak Na, K, Mg, Ca,
- LiCO3 mániás depresszióban gyógyszer
- Be- mérgezo (Mg helyettesítés), 90Sr- radioaktív,
Ba- idegméreg (de BaSO4 röntgen kontrasztanyag) - Biológiai hatásuk
- egyenetlen eloszlás sejten belül K, Mg2
- sejten kívül Na, Ca2
- ionpumpák révén valósul meg (szelektív kötohelyu
fehérjék) - sav-bázis egyensúly, ozmótikus egyensúly
fenntartása (K, Na) - fiziológiai folyamatok szabályzása (pl. Ca2
izomösszehúzódásban) - enzimek aktiválása (Mg2), foszfatázok, ATPáz,
- klorofill alkotórésze (Mg2), fotoszintézis
- vázanyag (csont, fog) 3Ca3(PO4)2CaF2
(tojáshéj) CaCO3, koképzodés pl. Ca(COO)2